随着生物科学和医学技术的进步与发展,我们对于口腔疾病的认识也在不断加深。2020年底,美国牙科研究协会展开了以“ 下个世纪的科学:深度表型测量(Science for the Next Century: Deep Phenotyping)”为主题的专题讨论会。
在这场关于深度表型测量的讲座中,牙科专家们介绍了龋齿、牙周病、牙科微生物组和颅面畸形学科的研究进展以及关注点。该研讨会内容于近日发表在牙科杂志 Journal of Dental Research 上。
现在,让我们一起走进当代生物科学的最前沿,来了解一下关于牙齿医学与表型的最新研究吧。
首先,什么是表型?它和我们熟知的基因有什么联系?
表型,是生命体的生物特征。表型组,是指生物体从微观(即分子)组成到宏观、从胚胎发育到衰老死亡全过程中所有表型的集合。简单来说,基因(内因)与环境(外因、含环境暴露和生活方式)共同决定了表型。
那什么又是深度表型测量(Deep phenotyping)?
随着获取和评估人类基因组信息能力的进步,人们逐渐意识到健康和疾病是由很多因素决定的,其中包括遗传学、转录组学、蛋白质组学、代谢组学、微生物组学,以及生活方式和环境影响。了解健康和疾病状态下人群的表型变化情况,对于实现精准医疗至关重要。将表型扩展到更精细的水平(如深入的表型分析)将有助于提高我们对健康和生命的理解。
深度表型测量是对遗传学、表观遗传学、生活方式和环境影响进行精确和整体性分析的工具,并需要大量从临床层面到分子层面的信息做支撑。“深度”是指对少量受试者进行跨尺度、长时间的精密测量,从而获得完整且成体系的数据,通过挖掘不同层面数据间的联系,探索之前未发现的潜在规律。
下面这张图就非常直观地为我们展示了口腔、牙齿和颅面表型(包括观察和评估)从宏观表型测量到微观表型测量的参数变化。
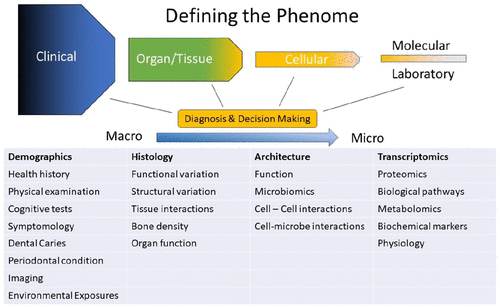
与传统的单性状分析相比,深度表型测量作为一种发现工具,可同时进行全基因组关联分析,揭示表型与分子机制之间未发现的联系。这些联系将帮助医生对症下药,有效提高诊断质量,为了解未知疾病及其发病机制奠定基础,并为最终找到合适的治疗方案提供可能。
既然深度表型研究对于牙病治疗有这么大的作用,我们就来了解一下,在这场关于表型和牙病研究的顶尖国际会议中,各位科学家是如何阐述相关问题的。关于牙病(龋齿、牙周病、牙科微生物组和颅面畸形)到底在表型上有哪些不同呢?相关的研究现在有哪些新的进展?

Leslie Biesecker博士是美国国立卫生研究院荣誉研究员,国家人类基因组研究所下属精准医疗研究中心主任。Biesecker博士是四本生物医学期刊的编辑或董事会成员,是Illumina公司的顾问,还是美国人类遗传学会(American Society of Human Genetics)的董事会成员。
开幕式上,Leslie Biesecker博士的发言中说,随着低成本、高通量的基因组分析技术的进步,医疗模式和疾病管理方法正在发生演变。评估患者并提供治疗的传统方案也随之发生改变,对疾病的早期预防或干预逐渐成为口腔医学的新风向。
Biesecker博士和Kimon Divaris博士则讨论了评估群体而不是仅仅是个体表型和基因型的重要性。他们认为,如果像传统诊断方法一样基于表型招募研究个体,会导致先验假设的固有偏见。根据目标基因型来评估群体,并通过特定基因变异确定研究对象,然后集中深入地分析表型,有助于确定与该基因相对应的表型。不幸的是,许多大规模群体基因分型没有进一步的表型评估,这大大限制了对于特定表型的分析。在这场报告中,专家提出,我们必须识别和评估疾病过程(如不良微生物菌群、炎症反应失调),而不仅仅着眼于疾病结果(如龋齿病变,牙龈附着丧失)。通过对大量人群进行基因分型和使用表型测量,结合进一步对其中少量人群使用深度表型测量的方法,将有利于理解人类基因组及其对表型的影响。
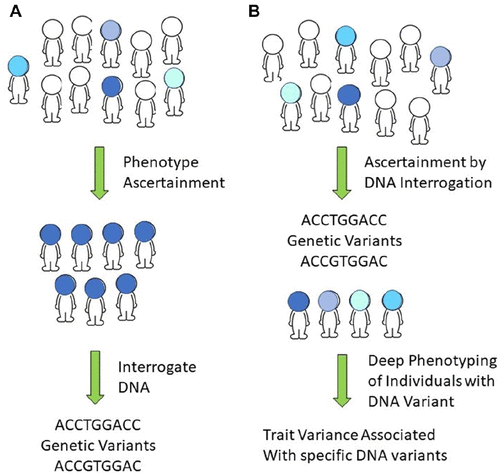
图:传统疾病的诊断:确定一种特定的疾病表型,然后发现相关的DNA变异(A)。随着测序技术的发展,可以在普通人群中识别基因变异,最后识别与特定基因相关的表型变异,这在传统诊断方法中常被忽略(B)。
龋齿与牙周病
龋齿俗称蛀牙,细化龋病表型是揭示生物膜介导的牙齿硬组织脱矿过程中复杂生物学联系的关键。脱矿过程,即为牙釉质因细菌活动而损坏的过程。龋齿和牙周病是个体异质性较大的疾病,精确诊疗前需要了解患者的牙齿生物膜接触面、所处环境以及基因变异的情况。
了解该生物学过程对于我们理解表型并最终干预疾病至关重要。目前临床评估龋齿发病程度的方法有统计龋齿腐烂、缺失和填充表面的数目,但是上述均为关于龋齿结果的描述,并不包含过程。口腔微生物群极其多样化,约有2000种细菌、古细菌、病毒和真菌。菌斑生物膜群落的改变可能导致龋齿。Divaris博士的研究使用潜在类别分析,确定了儿童早期龋齿的亚型及相关的微生物特征。近年来,有多位专家发表了关于深度表型如何助力龋齿研究的学术论文,如建议将成人龋齿分型;将生物膜代谢组学分析与机器学习相结合,为儿童早期龋齿分型及预后提供生物信息学方法;在大量人群中使用深度表型深入了解龋齿、牙周病及其假定亚型的分子基础等。因此,了解病理条件的分子基础,即相关表型的深度测量,可以为评估患病风险、疾病预后以及基于这些因素的干预措施提供更多信息。

Jim Beck博士是北卡罗来纳大学教堂山分校牙科学院牙科生态系的杰出教授,同时也是该大学医学院流行病学系的兼任教授。他曾是NIDCR几个特殊研究部门的成员,例如口腔生物学和医学研究部门的常规成员。同时现在还担当许多咨询小组的成员,其中包括医学研究所、美国牙周病学会、美国牙科协会和疾病控制中心。
Jim Beck博士回顾了牙周病的遗传决定因素。用炎症和生物膜测量来辅助牙周健康和疾病的临床评估,可以帮助确定疾病的致病因素和机制,阐明严重的慢性牙周病和其他疾病之间的关系(如心血管疾病)。在2018年,Beck博士提出牙周测写分类(periodontal profile class,PCC),即表征每颗牙齿的健康和疾病信息可以作为个体牙周表型的分类基础,将相同类型的研究参与者分为一组进行更深入的研究。PCC分类被认为比牙周病世界研讨会分类更具遗传学和生物学基础。了解与牙周疾病相关的生物过程并对其评估,将有助于疾病轨迹的预测、方便未来提供更直接的治疗和干预。
牙齿和颅面表型

Ophir Klein博士是加州大学旧金山分校口腔科学与儿科学教授,遗传学系主任,颅面异常科主席。该教授于2018年当选了美国国家医学院(National Academy of Medicine)院士。
许多疾病与牙齿、口腔和颅面结构的改变有关,这些表型的变化可能是综合征最初的表现。Tim Wright博士阐述了与牙齿和牙釉质形成相关的基因突变及引发的各种临床表型。
Ophir Klein博士、Benedikt Hallgrimsson博士和Janice Lee博士提出,将颅面部表型组学(颅面包含骨骼、牙齿及有关软组织,是面部的形态)和深度表型测量分型作为诊断和临床基因测序的重要补充。成像技术的发展提高了我们形态学定量分析的能力,加深了对发育生物学和临床表型定量及评估的理解。面部形状变异是多基因作用的结果。人脸呈现出的表型,可用于确定形态异常的原因和遗传评估。三维成像结合机器学习,使特定遗传条件分类拥有高识别率和特异性,足以区分出相关但未受影响的家族成员。使用断层扫描识别和验证三维颅面标志物,提供了额外的表型体征来评估生长、发育和诊断,还能够指导治疗和手术过程。
微生物组和多组学表型

Michael Gilmore博士是哈佛医学院眼科学教授,传染病研究所所长,同时是哈佛大学抗生素耐药性计划以及学术界/行业联盟波士顿地区抗生素耐药性网络(BAARN)的创始人和首席研究员。他在公共(NIH,FDA,VA,NSF,EU)和私人组织的众多咨询委员会和委员会中任职,主要致力于药物发现、抗生素抗性和细菌发病机理。
最后一组报告探讨了口腔微生物群落的深度表型。Michael Gilmore博士介绍了位于牙齿内部牙髓感染中常见的持续性病原体——粪肠球菌。代谢组学深度表型测量有助于识别特定基因和生物合成基因簇(基因簇指两个或多个相似或相同的基因成串排列在一起)、揭示个体对药物的敏感性、确定构成表型的基因簇和基因网络,以及阐明复杂的遗传途径。

Anna Edlund博士是美国加州大学圣地亚哥分校医学院儿科助理教授,同时也是克雷格·文特尔研究所(J. Craig Venter Institute)的助理教授,致力于攻克人类口腔微生物组相关难题。
Anna Edlund博士介绍了她基于多组学方法所创建的综合表型,用以描述儿童易患龋齿的情况。该表型可通过唾液样本来确定在深层龋病发生时,患者口腔中微生物群落和免疫因子的代谢组学变化情况。该综合表型提供了用初级和次级代谢物描述龋齿发病状况的方法。

[1] WRIGHT, J. T. & HERZBERG, M. C. 2021. Science for the Next Century: Deep Phenotyping. J Dent Res, 220345211001850.
[2] AGLER, C. S., et.al. 2019. Biologically Defined or Biologically Informed Traits Are More Heritable Than Clinically Defined Ones: The Case of Oral and Dental Phenotypes. Adv Exp Med Biol, 1197, 179-189.
[3] BECK, J. D., et.al. 2018. In search of appropriate measures of periodontal status: The Periodontal Profile Phenotype (P(3) ) system. J Periodontol, 89, 166-175.
[4] BECK, J. D., et.al. 2020. Periodontal disease classifications and incident coronary heart disease in the Atherosclerosis Risk in Communities study. J Periodontol, 91, 1409-1418.
[5] HALLGRíMSSON, B., et.al. 2020. Automated syndrome diagnosis by three-dimensional facial imaging. Genet Med, 22, 1682-1693.
[6] HEIMISDOTTIR, L. H., et.al. 2021. Metabolomics Insights in Early Childhood Caries. J Dent Res, 100, 615-622.
[7] LIBERTON, D. K., et.al. 2019. Development and Validation of Novel Three-Dimensional Craniofacial Landmarks on Cone-Beam Computed Tomography Scans. J Craniofac Surg, 30, e611-e615.
[8] OFFENBACHER, S., et.al. 2018. GWAS for Interleukin-1β levels in gingival crevicular fluid identifies IL37 variants in periodontal inflammation. Nat Commun, 9, 3686.
[9] XIONG, Z., et.al. 2019. Novel genetic loci affecting facial shape variation in humans. Elife, 8.
[10] https://www.genome.gov/staff/Leslie-G-Biesecker-MD
[11] https://dentistry.unc.edu/people/james-beck/
[12] https://profiles.ucsf.edu/ophir.klein
[13] https://researchers.masseyeandear.org/details/304

